新たなラマンイメージングの基準で、あらゆる方向へ研究を進めましょう
製品情報
microscope components and accesories
分光器顕微鏡コンポーネントラマン測定フィルターTruePower – レーザーパワー補正システムエンクロージャーと架台 – 環境影響の削減スキャンステージ環境制御
共焦点ラマン顕微鏡は、非侵襲的かつラベルフリーであることから、細胞生物学において強力な手法です。レーザーで分子を励起し散乱光を取得することで、細胞の化学的・構造的情報が得られます。これにより、脂質、タンパク質、核酸などの異なるバイオ分子とその細胞内分布を可視化できます。現在の細胞生物学研究では、ラマンイメージングが特に脂質組織化、代謝、感染、薬物取り込みなどの細胞プロセス研究に活用されています[1-7]。共焦点ラマンイメージングの高空間分解能と化学的特異性は、多様な生物学的プロセスにおける細胞の複雑な動態を理解するための貴重なツールです。
WITec システムの卓越したラマン技術は、最高の解像度、速度、感度を同時に実現し、貴重なサンプルから最良の結果を引き出します。比類のない汎用性を備えた WITec のラマン顕微鏡は、現在および将来の研究要件に適応するための最適な基盤です。生きた標本を使用する生物学的用途向けに、環境および温度制御用の互換デバイスもご用意しています。
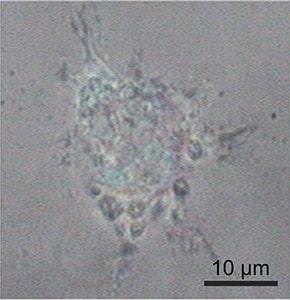
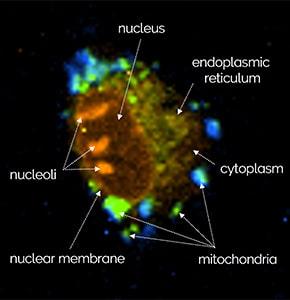
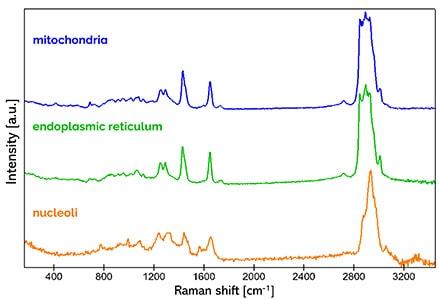
共焦点ラマンイメージングは非破壊的な顕微鏡技術であるため、生きた細胞を生理的な環境下で損傷を与えることなく研究するのに最適です。この例では、WITec alpha300 ラマン顕微鏡を使用して、ラットの上皮細胞を調査しました。ミトコンドリア(青)、小胞体(緑)、核小体(オレンジ)の典型的なラマン分光スペクトルが検出されました。色分けされたラマン画像は、これらの細胞小器官の細胞内位置を可視化しています。
詳細については、当社のアプリケーションノートをご覧ください。
WITec ラマンシステムでは、共焦点と優れた深度分解能の組み合わせにより、3D でも細胞の詳細を分解して観察することができます。このアニメーションは、ハイドロゲル内の間葉系細胞の 3D ラマン画像を示し、選別されたさまざまな細胞成分を可視化しています
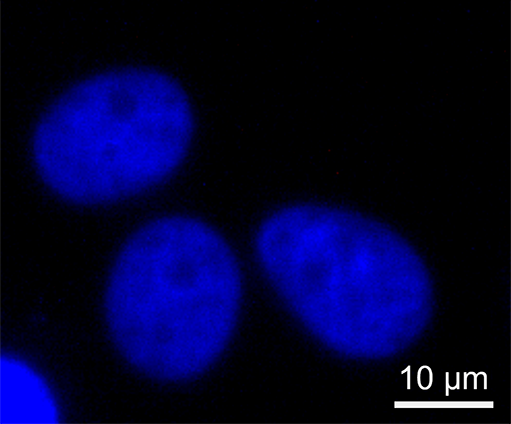
細胞生物学の研究において、蛍光標識は特定の分子を可視化する一般的な手法です。ラマンイメージングは、この手法に代わる強力な手法ですが、WITec の顕微鏡では、追加の蛍光マーカーが必要な用途向けに、この 2 つの手法を組み合わせて使用することができます。これらの画像は、DAPI で染色した真核細胞の相関ラマンイメージングと蛍光イメージングです。蛍光イメージでは、標識された細胞核が可視化され、ラマンイメージングでは、小胞体(緑)と核小体(オレンジ)が識別されています。
詳細については、当社のアプリケーションノートをご覧ください。
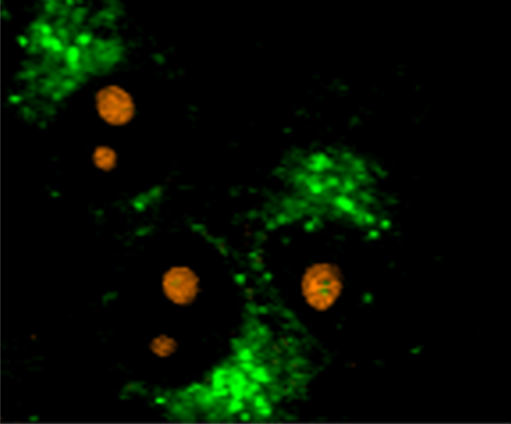
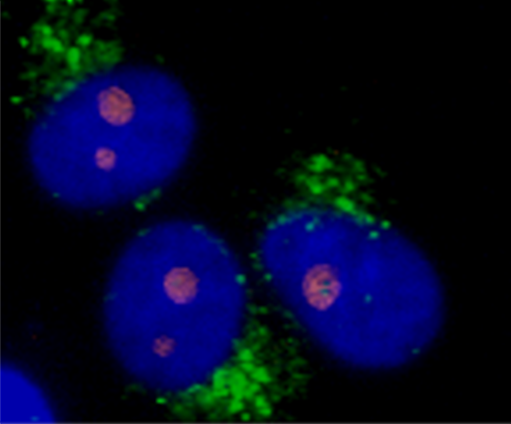
WITec の汎用性の高い装置は、ラマン顕微鏡とさまざまな他のイメージング技術を組み合わせ、同じサンプル位置から補完的な情報を提供することができます。
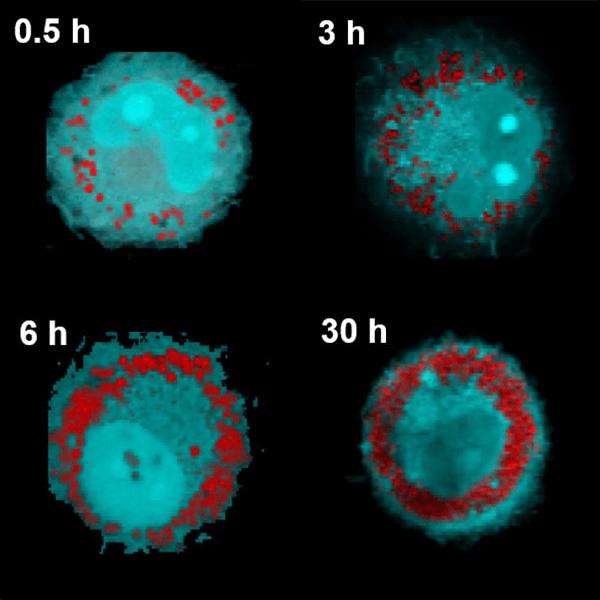

アプリケーションノート ライフサイエンスにおける共焦点ラマンイメージングと相関技術
Customer publications: